戈沙妥珠单抗在中国上市,为三阴性乳腺癌患者带来全新治疗方案
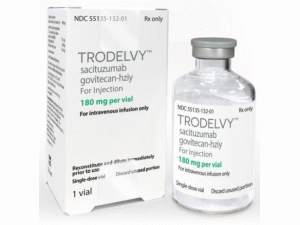
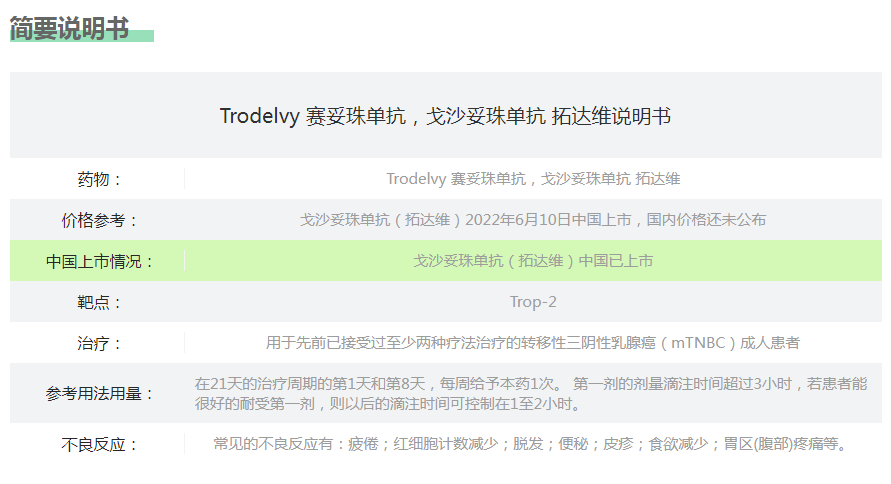
2022年6月10日,生物制药公司云顶新耀宣布,全球首个且唯一获批的靶向Trop-2 的ADC药物戈沙妥珠单抗(商品名:拓达维,Trodelvy )获中国国家药品监督管理局(NMPA)批准上市,用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。这也是云顶新耀获准在中国上市的首款创新药品。

三阴性乳腺癌是一种高度侵袭性疾病,约占全球所有乳腺癌类型的15%。与其他类型的乳腺癌相比,三阴性乳腺癌有效的治疗方案极其有限。此外,三阴性乳腺癌比其他类型的乳腺癌复发和转移的几率更高,转移复发的平均时间约为2.6 年,而其他乳腺癌为5年,相对的5年生存率更低,在转移性三阴性乳腺癌女性患者中,5年生存率为12%,而其他类型转移性乳腺癌患者的5 年生存率为28%。
中国工程院院士、国家新药(抗肿瘤)临床研究中心主任、拓达维中国注册研究主要研究者徐兵河教授表示:“三阴性乳腺癌患者临床上急需新的有效治疗方案。我目睹了戈沙妥珠单抗,即拓达维引进到中国的全过程,并牵头开展了在中国的注册性临床研究。很高兴戈沙妥珠单抗在国内临床研究与国际上一样均展现了良好的治疗效果,作为临床医生,我们期待这款新药尽早应用到临床,拯救更多患者的生命。”
目前,拓达维已在超过35个国家/地区获批用于治疗既往接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。2020年10月,被纳入到更新的2020版《中国晚期乳腺癌规范诊疗指南》。2021年10月,被纳入《中国抗癌协会乳腺癌诊治指南与规范(2021)》。2022年4月又被纳入更新的《2022中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》。
云顶新耀方面表示,预计在今年第四季度商业化上市这款新产品,同时将继续与合作伙伴吉利德推进拓达维的后续临床研究,以用于多种肿瘤类型以及更前线的治疗。
戈沙妥珠单抗是一种专治疑难癌症的ADC药物,对多种棘手的癌症有奇效。比如乳腺癌中最难治的三阴乳腺癌,戈沙妥珠单抗能有35%的有效率和5.6个月的中位无进展生存期,分别是化疗的7倍和2倍多。对PD-1耐药的膀胱癌患者,戈沙妥珠单抗也给出了27.4%的有效率和5.4个月的中位无进展生存期。
据悉,180mg一支的戈沙妥珠单抗注射用粉剂售价为2313美元,约合1.55万元人民币。根据推荐用法,体重50kg的患者,每3周的治疗花费大约需要13万元。随着国内的上市,希望价格给力,尽早纳入国家医保,造福更多的患者!
简介:
Trodelvy(戈沙妥组单抗)是吉利德公司研发的一款抗Trop-2靶点的ADC药物,于2020年获得美国食品药品监督管理局(FDA)批准上市。Trodelvy(戈沙妥组单抗)是第一个可提高转移性三阴性乳腺癌(mTNBC)患者无进展生存期(PFS)和总生存期(OS)的疗法,标志着三阴性乳腺癌(mTNBC)治疗方面的一个重大进步。
2020年4月22日,美国食品药品监督管理局(FDA)已批准Trodelvy上市申请,用于先前至少接受过两次转移性疾病疗法治疗的,不可切除性局部晚期或转移性三阴性乳腺癌(mTNBC)成人患者。Trodelvy是FDA批准的首个专门治疗复发或难治性mTNBC的抗体药物偶联物(ADC)药物,也是FDA批准的首个抗人滋养层细胞表面抗原2(Trop-2)的ADC药物。
2021年4月7日,美国食品和药物管理局(FDA)批准Trodelvy(sacituzumab-govitecan-hziy)用于治疗之前接受过两次或更多的全身治疗,其中至少有一个是转移性疾病的,无法切除的局部晚期或转移性三阴性乳腺癌(TNBC)成年患者。
2021年4月13日,Trodelvy再获美国FDA批准一个新的适应症,用于治疗先前接受过含铂化疗、还接受过一种PD-1抑制剂或一种PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(UC)成人患者。
Trodelvy也被开发用于治疗HR /HER2-转移性乳腺癌和转移性非小细胞肺癌(NSCLC),对多种实体瘤的额外评估也在进行中。
2022年6月10日,国家药品监督管理局(NMPA)信息发布,戈沙妥珠单抗(商品名:拓达维,Trodelvy)在国内获批,这是全球首个且唯一获批的靶向Trop-2的ADC药物,用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者,三阴乳腺癌患者有了新的选择方案,打破现有治疗困境。
热门药品
相关资讯