K药入局双免 “K+Q” PK “O+Y” 双免时代组合之争已打响!
以帕博利珠单抗(K药)和纳武利尤单抗(O药)为代表的PD1/PDL1免疫治疗重塑了肿瘤治疗的格局,一直被人津津乐道的“OK之争”在肿瘤治疗中也形成了一种良性竞争的格局,不断推动疗效的提升。而面对单药疗效的局限,免疫联合成为近2年的趋势。K药及一众国产PD1,更是引领了肺癌消化道等癌种化免联合的年度高潮。但是,扪心一问,免疫时代,我们还是脱离不了化疗吗?
对此,O药以O Y的PD1联合CTLA4的双免模式,实现了突破。2020一年,免疫双子星O Y已经斩获第七个适应症,横跨六大癌种,开创了双免泛癌种治疗的成功治疗模式。而K药也是不甘落后,积极布局双免,并获得初步成效。近日,Annals of oncology报道了K Q(一种新型CTLA4单抗)一线治疗晚期非小细胞肺癌(NSCLC)的数据。一起了解一下双免治疗疗效。

K Q初显成效
Quavonlimab(MK-1308,Q药)是一种新型抗CTLA-4抗体,研究旨在探索Q药与K药一线治疗NSCLC的安全性和有效性。研究分为剂量递增阶段(DE)和剂量确认期(DC)。
剂量递增阶段(DE):研究纳入晚期/转移性实体瘤的患者,首先使用Q药治疗(25 mg [组1],75 mg [组2]或200 mg [组3]),然后是相同的quavonlimab剂量加K药 Q3W治疗。
剂量确认期(DC):IIIB / IV期非小细胞肺癌患者接受一线Q药(25 mg Q3W [A组],25 mg Q6W [B组],75 mg Q6W [C组]或75 mg Q3W [臂E])加K药。主要研究终点是安全性和耐受性,并确定与K药一起使用时推荐的Q药 II期推荐剂量(RP2D)。次要研究终点是ORR。
结果显示:DE阶段共纳入39例患者( n = 14 [组1];n = 17 [组2];n = 8 [组3]);DC 阶段纳入134例患者( n = 40 [A];n = 40 [B];n = 40 [C];n= 14 [E])。未达到最大耐受剂量。在DE阶段1、2和3组中,与治疗相关的3-5级AE分别占0%,23.5%和75.0%,而DC阶段A,B,C和E对列患者分别占35.0%,30.0%,35.0%和57.1%。
在NSCLC患者中ORR分别为40.0%(95%CI,24.9-56.7; A组),37.5%(95%CI,22.7-54.2; B组),27.5%(95%CI,14.6-43.9; C组)和35.7% (95%CI,12.8-64.9;E组)。
结果显示,Q药 25 mg Q6W加K药显示出很好的疗效和安全性,可作为扩展组的推荐剂量。
K Q的双免组合首次亮相,以绝对的疗效优势力压了单免疗效,且实现了泛肺癌人群的无化疗治疗。而除了K Q的早期疗效优势之外,0 Y已经通过Checkmate-227和Checkmate9LA两大研究证实了双免治疗在驱动基因阴性的所有非小细胞肺癌患者一线优于化疗的生存提升!
O Y肺癌一线已获两大适应症,去化疗模式可行!
1.O Y双免获批肺癌一线
Checkmate-227研究纳入了无EGFR/ALK突变的晚期初治非小细胞肺癌患者,对于Ia部分PD-L1≥1%的患者(1189例),继续随机分为三组:NIVO(3 mg/kg Q2W) IPI(1mg/kg Q6W)组、化疗组、NIVO单药(240mg Q2W)组。
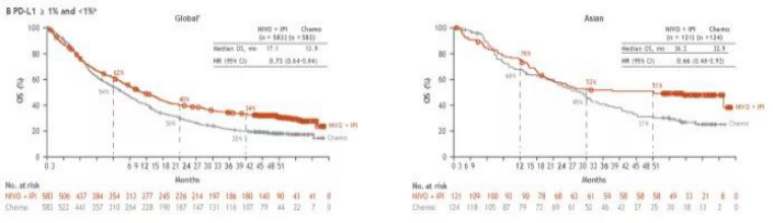
结果显示,在ITT人群中(PD-L1≥1%和PD-L1<1%),全球数据和亚裔数据均显示双免可为患者带来更好的生存获益。亚裔双免疫组1年、2年、3年OS率分别为76%、53%和51%,双免对比化疗中位OS为36.2个月vs 22.9个月(HR=0.66,95%CI 0.48-0.92),与单纯化疗相比,双免降低了亚裔患者34%的死亡风险。全球双免疫组1年、2年、3年OS率分别为62%、40%和34%,双免对比化疗中位OS为17.1个月vs 13.9个月(HR=0.73,95%CI 0.64-0.84),与单纯化疗相比,双免降低了全球患者27%的死亡风险。
2.精益求精 O Y 两周期化疗肺癌一线再获批!
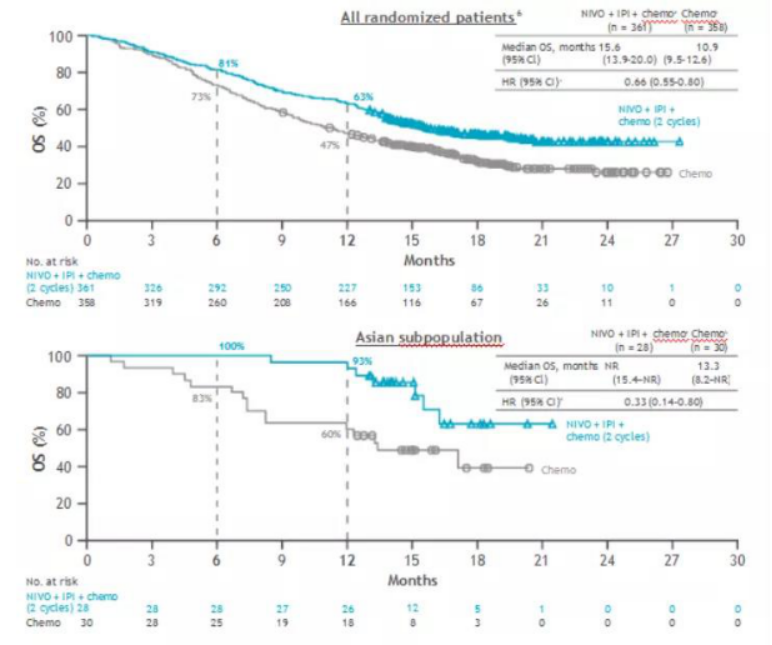
为了弥补免疫起效慢、早期出现假性进展等不足,Checkmate9LA研究把双免方案优化了一下,在O Y双免基础上加入了2周期化疗。全球数据显示,联合组的中位OS显著优于化疗组(15.6个月 vs 10.9个月,HR 0.66),双免降低死亡风险34%。免疫联合组和化疗组的半年、1年OS率分别为81%vs73%和63% vs 47%。
亚裔数据生存获益和获益趋势全面赶超全球数据,联合组和化疗组的中位OS为NR vs 13.3个月,随访21个月依然未达到中位OS,但可以看到更为显著的获益趋势, HR 0.33,双免降低死亡风险67%。半年OS率100%,一年OS率93%,创晚期NSCLC一年生存率新高!
O Y的目前国内获批在即,在双免战场上,K药需要紧追步伐啦。但从临床治疗角度,我们看到了双免治疗的不断验证,无论是近期疗效,还是远期生存,甚至是不同的PD1 CTLA4方案间,都为我们开启双免时代的到来点亮希望。而O Y的双免组合不仅在肺上获佳绩,在肺外的其他五大癌种中也已经获得了适应症。
O Y 手握六大癌种 七大适应症
从2015年起至今,O Y的双免疫组合已经拿下了五个癌种的适应症:
2015年10月,FDA批准O Y用于不可切除性或转移性黑色素瘤的一线治疗。
2018年4月,FDA批准O Y用于中高危晚期肾细胞癌的一线治疗。
2018年7月,FDA批准O Y用于12岁及以上儿童或成人微卫星高(MSI-H)或错配修复缺陷(dMMR)转移性结直肠癌患者的治疗。
2020年3月,FDA批准O Y用于既往索拉菲尼耐药的晚期肝细胞肝癌患者(二线治疗)。
2020年5月15日,FDA批准O Y用于EGFR/ALK突变阴性的PD-L1≥1%的晚期非小细胞肺癌的一线治疗。
2020年5月26日,FDA批准O Y 2周期含铂化疗用于EGFR/ALK突变阴性的晚期非小细胞肺癌的一线治疗(无需考虑PD-L1表达)。
2020年10月,FDA批准O药联合抗CTLA-4抗体伊匹木单抗(Y药)一线治疗无法通过手术切除的恶性胸膜间皮瘤(MPM)成人患者。
1.O Y双免黑色素瘤一线地位确定
纳武单抗联合伊匹单抗一线治疗黑色素瘤的获批基于CHECKMATE-067研究,患者按1:1的比例随机分组至纳武单抗 伊匹单抗组、纳武单抗单药组和伊匹单抗组。研究结果表明,纳武单抗联合伊匹单抗组患者的mPFS为11.5个月,确定的ORR为50%,CR为8.9%,≥6个月DOR的患者比例为76%!

2.肾癌一线获批 疗效显著优于标准治疗!
纳武单抗联合伊匹单抗一线治疗肾癌的获批基于CHECKMATE-214研究,患者按1:1的比例随机分组至纳武单抗 伊匹单抗组、纳武单抗单药组和舒尼替尼组。研究结果表明,两组(纳武单抗 伊匹单抗 vs 舒尼替尼)的OS为NE(未达到) VS 25.9个月,死亡率为32.9% VS 44.5%,ORR为41.6% VS 26.5%,中位PFS为11.6个月 VS 8.4个月。

3.二线获批 冲击一线 O Y成为MSI-H/dMMR型mCRC新一线治疗选择
纳武单抗 伊匹单抗已获FDA批准用于在氟嘧啶、奥沙利铂、伊立替康等药物治疗后进展的微卫星不稳定 (MSI-H)或错配修复缺陷(dMMR)的转移性结直肠癌患者。研究结果表明,二线治疗的ORR为46%,CR为4.2%,47%的患者发生了严重的不良反应。
在一线治疗方面,Checkmate142研究为II期临床试验纳入45例既往未接受过转移性疾病治疗的患者(pts)接受纳武单抗 3 mg/kg Q2W 低剂量伊匹单抗1 mg/kg Q6W,直至疾病进展或停药。主要终点是客观应答率ORR。本次公布的为患者2年长期随访的有效性和安全性(中位随访29个月)。
结果显示:ORR:69%,CR为13%。mDOR:NR。mPFS:NR,2年PFS率为74%。mOS:NR,2年OS率为79%。

相较于之前的数据,此次ORR和CR都有提高,ORR 从 60%提高到 69%, CR从7%提高到13%,纳武单抗 低剂量伊匹单抗显示出稳定、持久的临床获益,并且随着随访时间的延长,耐受性良好,没有发现新的不良反应。O药 低剂量Y药可能是MSI-H/dMMR型mCRC患者新的一线治疗选择!
4.肝癌首个获批的“双免疫”方案!打造二线最高疗效ORR32%!
CheckMate-040的1/2期研究,共纳入148例既往接受过索拉非尼治疗进展或不耐受的晚期肝癌患者, 以1:1:1的比例被随机分配到A、B、C三组中。A组(n=50): O药1mg/kg Y药3mg/kg,(O1 Y3)每3周一次,连续4个用药周期后续贯O药240mg,每2周一次;B组(n=48): O药3mg/kg Y药1mg/kg,(O3 Y1)每3周一次,连续4个用药周期后续贯O药240mg,每2周一次;C组(n=48): O药3mg/kg Y药1mg/kg,(O3 Y1)其中O药每2周一次、Y药每6周一次。
结果显示:ORR:33%(95%CI:20-48),CR为8%、PR为24%。各组的具体疗效,在2019年ASCO会议上报道如下:A组 :ORR为32%,CR为8%,PR为24%,OS为22.8个月;B组 :ORR为31%,CR为6%,PR为24%,OS为12.5个月;C组 :ORR为31%,CR为0%,PR为31%,OS为12.7个月。
5.恶性胸膜间皮瘤一线获批
2020年10月,FDA批准O药联合抗CTLA-4抗体伊匹木单抗(Y药)一线治疗无法通过手术切除的恶性胸膜间皮瘤(MPM)成人患者,这是16年来批准的首个间皮瘤物疗法,也是首个且目前唯一获批的免疫疗法。此次获批是基于CheckMate -743的三期临床试验。CheckMate-743是一项全球多中心、随机、对照的Ⅲ期临床研究,入组605例既往未经治疗的、不可切除恶性胸膜间皮瘤患者,一线接受纳武利尤单抗联合伊匹木单抗(O Y,n=303)或标准化疗(培美曲塞 顺铂/卡铂)(n=302)。研究结果显示:与化疗组相比,O Y组的中位OS显著延长(18.1个月 vs 14.1个月),死亡风险降低26%。O Y组的2年生存率为41%,而化疗组仅为27%。
目前,纳武利尤单抗于2018年已经在中国上市,而伊匹木单抗于2011年已经在国外上市。不过,伊匹木单抗在2019年12月就已经提交了在国内的上市申请,新药上市在即,我们一起期待吧!总之,O Y的双免疫治疗方案开创了免疫治疗的新思路,至今已经斩获七大适应症,K Q方案也崭露头角,期待未来更多的免疫联合方案取得更好的疗效。
参考文献:
https://www.annalsofoncology.org/article/S0923-7534(20)43175-8/fulltext
本文来源:找药宝典
热门药品