近20年来首款!罗氏维泊妥珠单抗获批一线治疗DLBCL
关于“近20年来首款!罗氏维泊妥珠单抗获批一线治疗DLBCL”的相关内容,相信很多病友都想知道,为了方便大家了解,觅健小编搜集整理了有关“近20年来首款!罗氏维泊妥珠单抗获批一线治疗DLBCL”的一些资料分享给大家,希望能帮助到大家,供参考。
罗氏宣布维泊妥珠单抗(Polivy)获FDA批准用于联合R-CHP方案(利妥昔单抗 环磷酰胺 多柔比星 泼尼松)治疗未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)患者。
近期,全球首个靶向CD79b的抗体药物偶联物(ADC)维泊妥珠单抗也在中国成功获批上市,其获批的两项适应症分别为:联合利妥昔单抗、环磷酰胺、多柔比星、泼尼松(R-CHP)用于治疗初治弥漫性大B细胞淋巴瘤(DLBCL)成人患者;联合苯达莫司汀、利妥昔单抗(BR)用于治疗不适合接受造血干细胞移植的复发或难治性(R/R)DLBCL成人患者,为中国DLBCL患者带来了全新的治疗选择。
此次批准主要是基于III期POLARIX研究的关键积极结果。该研究是一项全球性、多中心、随机、双盲、安慰剂对照的临床试验,共纳入879例患者,旨在评估Polivy联合R-CHP对比R-CHOP(利妥昔单抗 环磷酰胺 多柔比星 长春新碱 泼尼松)治疗未经治疗的DLBCL患者的有效性和安全性。研究的主要终点为研究者使用Lugano分类标准(常用的一种淋巴瘤疗效评价标准)评估的无进展生存期(PFS)。
结果显示,与R-CHOP组相比,Polivy联合R-CHP组患者的PFS在统计学意义和临床意义上延长,可将患者的疾病进展、复发或死亡风险降低27%(HR=0.73;95%CI:0.57–0.95;p<0.02)。Polivy联合R-CHP组患者的2年PFS率为76.7%(95%CI:72.7–80.8),R-CHOP组这一比例为70.2%(95%CI:65.8-74.6)。
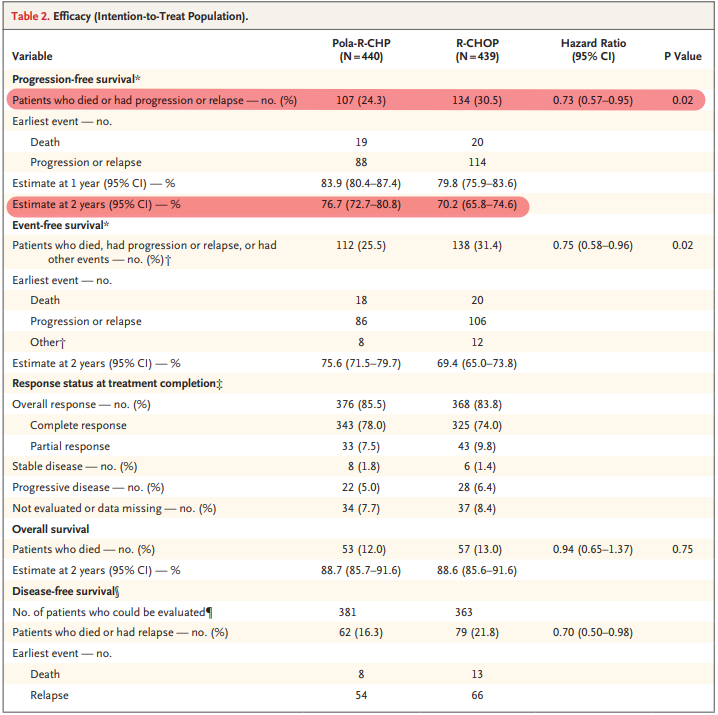
POLARIX研究疗效数据(来源:NEJM)
安全性方面,Polivy联合R-CHP与R-CHOP的总体安全性基本相似,未发现新的安全信号。最常见的3级或4级不良事件(AE)是中性粒细胞计数减少(28.3% vs 30.8%)、发热性中性粒细胞计数减少(13.8% vs 8.0%)和贫血(12.0% vs 8.4%)。此外,两组之间因中性粒细胞计数减少或感染而停用试验方案中至少一种药物(2.1% vs 2.3%)或减少剂量(1.8% vs 2.5%)的事件发生率相似。
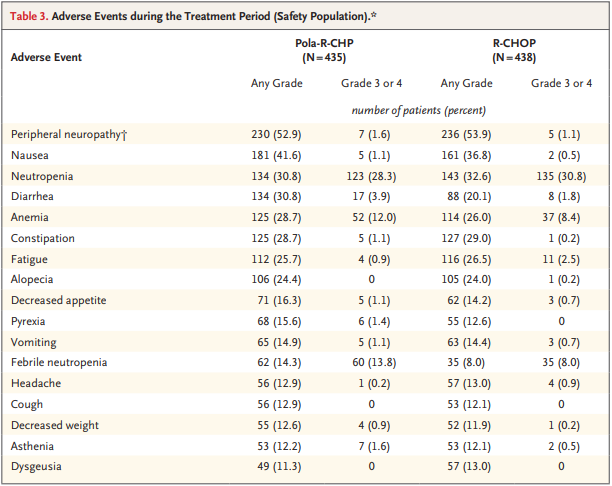
POLARIX研究安全性数据(来源:NEJM)
Polatuzumab vedotin于2019年6月10日获美国食品药品监督管理局(FDA)批准上市,商品名为Polivy®,与苯达莫司汀和利妥昔单抗联合治疗至少接受过2次治疗的复发性或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者。该药物于2017年9月获得美国FDA突破性疗法认定,于2016年12月获得治疗DLBCL的孤儿药指定。Polatuzumab vedotin是首款CD79b 靶向抗体偶联物(ADC)。
Polivy®是一种靶向B细胞抗原受体复合物相关蛋白β链(CD79b)的ADC,由3个组分构成:(1)靶向CD79的重组人源化IgG1单抗Polatuzumab;(2)可裂解型linker,mc-vc-PABC(maleimidocaproyl-valyl-citrullinyl-p-aminobenzyloxycarbonyl);(3)小分子药物MMAE(单甲基奥瑞他汀E)。抗体和MMAE经linker共价偶联在半胱氨酰上,药物抗体比率(DAR)平均为3~4。
MMAE是一种合成的巴胺素10衍生物,具有非常有效的抗有丝分裂作用,它通过阻断微管蛋白的聚合来抑制细胞分裂,实现抗肿瘤目的。由于MMAE的毒性,它不能用作药物本身。在淋巴瘤细胞中,作为游离毒素的MMAE其细胞毒性比多巴胺素10低200倍。MMAE分子高度稳定,在血浆、肝溶酶体提取物或蛋白酶如组织蛋白酶B中无降解迹象。在一些淋巴瘤、白血病和实体瘤临床实验中,MMAE表现出强大的活性。MMAE的效力是长春花碱的200倍,长春花碱是另外一种治疗霍奇金淋巴瘤的抗有丝分裂药物。
作为ADC的一部分,MMAE与识别癌细胞的单抗连接,并特异性靶向癌细胞。Linker在细胞外液中稳定存在,一旦ADC与抗原结合并进入癌细胞,linker被酶解,释放出毒性MMAE,MMAE便通过抑制细胞分裂来发挥抗肿瘤活性。
Polatuzumabvedotin是靶向CD79b蛋白的抗体偶联药物,通过破坏B细胞分裂而发挥作用。小分子MMAE通过linker附着于抗体上。抗体与CD79b结合,CD79b是一种B细胞特异性表面蛋白,是B细胞受体组成部分,在DLBCL患者中异常表达。与CD79b结合后,polatuzumab vedotin被内化,并且linker被溶酶体蛋白酶裂解从而释放出MMAE。MMAE与微管蛋白结合,破坏微管网络结构,从而抑制细胞分裂并诱导细胞凋亡。
DLBCL是弥漫性大B细胞淋巴瘤的英文缩写,该疾病是恶性淋巴瘤发病最多的一型,占非霍奇金淋巴瘤的30%-40%。可以是原发,也可以是其他低侵袭性淋巴瘤转化而来,虽然生物学行为属于侵袭性,但是部分病例仍可以治愈,所以患这种疾病的人群还是要积极治疗。
弥漫性大B细胞淋巴瘤的病理形态存在异质性,由于它的形态学分组,在不同患者间的重复性较差,2000年WHO关于淋巴造血系统肿瘤分类中使用DLBCL这一名称。
弥漫性大B细胞淋巴瘤是一组异质性肿瘤,易侵犯淋巴结外器官和组织,主要有胃肠道、中枢神经系统、骨等,继发中枢神经系统侵犯是一种严重的临床并发症。治疗方法有限且侵袭性大,必需结合其组织病理形态和特异抗体的免疫组织化学检测,进行诊断和鉴别诊断。
据估计,全球每年约有15万例DLBCL确诊病例。自利妥昔单抗2002年获批上市以来,R-CHOP方案一直是DLBCL的标准一线治疗方案,但多达40%的患者仍然会经历疾病复发或难以产生反应。目前仅利妥昔单抗(罗氏/渤健)、tafasitamab(MorphoSys/诺诚健华/Incyte)、瑞帕妥单抗(石药集团/神州细胞)和维泊妥珠单抗(罗氏/Seagen)获批一线治疗DLBCL。
125年来,罗氏始终走在医疗健康领域前沿。自1896年在瑞士创立以来,罗氏研发的创新药物和诊断产品已惠及全球数以百万计的患者。罗氏不遗余力地推进医疗健康发展,以期创造更大价值。凭借制药和诊断两大领域的独特优势,结合临床实践中的数据洞察,罗氏积极携手合作伙伴,致力于为每位患者提供合适的治疗方案。
罗氏首席医学官兼全球产品开发主管Levi Garraway博士说:“自新诊断为弥漫性大B细胞淋巴瘤的患者拥有的上一个新治疗选择至今,已经有近20年了。FDA今天批准Polivy与R-CHP联合疗法的决定为患者带来了急需的新治疗选择,这可能会改善患有这种侵袭性淋巴瘤的患者的结局并为其带来许多其他好处。”
开售|优罗华(注射用维泊妥珠单抗)[¥1.04万元/盒]
2023年04月01日,靶向CD79b的抗体药物偶联物(ADC)优罗华®(注射用维泊妥珠单抗)在中国全国上架开售。
在中国, 优罗华®(维泊妥珠单抗)注射用,规格为:30mg/瓶/盒,零售价为:¥10400元/盒。
优罗华®(英文商品名:Polivy®,中英文通用名:注射用维泊妥珠单抗/Polatuzumab Vedotin for Injection)在2项适应症获得中国国家药品监督管理局(NMPA)批准,分别为:联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松用于治疗既往未经治疗的弥漫大B细胞淋巴瘤(DLBCL)成人患者;以及联合苯达莫司汀和利妥昔单抗用于治疗不适合接受造血干细胞移植的复发或难治弥漫大B细胞淋巴瘤成人患者。
通过上述近20年来首款!罗氏维泊妥珠单抗获批一线治疗DLBCL的介绍,相信大家对于“近20年来首款!罗氏维泊妥珠单抗获批一线治疗DLBCL”有了一定的了解。觅健小编建议大家,如出现身体不适,请及时到正规医院就诊,以免错过最佳治疗时期,从而导致病情恶化。想要了解更多药品资讯可以继续关注觅健或者下载觅健APP!
温馨提示:患者必须要做到合理科学用药,在专业医生或药师指导下用药,根据个体病情选择合适的治疗方案。
热门药品